Calcium/calmoduline-afhankelijke kinase 2 (CAMK2) behoort tot de meest voorkomende eiwitten in de hersenen en vertegenwoordigt meer dan 1% van het totale eiwit. De CAMK2-familie bestaat uit vier verschillende enzymen die sterk op elkaar lijken (CAMK2A, CAMK2B, CAMK2D en CAMK2G), waarvan CAMK2A en CAMK2B de meest voorkomende eiwitten in de hersenen zijn. Onlangs hebben we patiënten geïdentificeerd met mutaties in een van de 4 CAMK2 genen (Küry, Am J Hum Genet 2017; Akita, Ann Clin Transl Neurol, 2018; Chi, eLife, 2018; Rizzi Am J Med Genet, 2020). Ongeacht welk CAMK2 gen is aangetast, alle patiënten lijden aan een milde tot ernstige verstandelijke beperking. Bovendien vertonen de meeste patiënten een verminderde motorische coördinatie, spraak- en taalstoornissen en gedragsproblemen. Soms komt epilepsie voor.
CAMK2-gerelateerde aandoeningen zijn zeer zeldzaam. Momenteel hebben we wereldwijd 70 patiënten geïdentificeerd, waarvan het merendeel een mutatie in het CAMK2A gen draagt. Functionele analyse in ons laboratorium heeft aangetoond dat de mutaties een remmend of effect op de eiwitfunctie kunnen hebben, en beide kunnen resulteren in een cognitieve ontwikkelingsstoornis.
Bij muizen was CAMK2 het eerste gen waarvan werd vastgesteld dat het cruciaal is voor leren en geheugenvorming. In het lab hebben we meer dan 20 jaar gewerkt aan het bestuderen van de rol van CAMK2 in de hersenen. We hebben muismodellen voor CAMK2A, CAMK2B en CAMK2G. Met behulp van deze muismodellen wil ons laboratorium de functie van CAMK2 in de ontwikkeling van de hersenen en dus ook zijn rol in cognitieve ontwikkelingsstoornissen onderzoeken, met behulp van een multidisciplinaire benadering van moleculaire biologie, elektrofysiologie en gedrag.
De rol van CAMK2 in de hersenen.
CAMK2 is een kinase, wat betekent dat het andere eiwitten kan fosforyleren (een fosfaatgroep plaatsen) op een ander eiwit (‘target’ genoemd). Door deze fosforylering worden verschillende processen in de cel geactiveerd of geremd. Om te begrijpen wat de belangrijke eiwitten zijn die door CAMK2 worden gereguleerd, hebben we het CAMK2A- en CAM2B gen bij muizen verwijderd en een uitgebreide analyse uitgevoerd om de meest belangrijke targets van CAMK2 te identificeren (Kool, J Neurosci, 2019).
De rol van CAMK2A en CAMK2B bij cognitieve ontwikkeling.
CAMK2 gerelateerde aandoeningen zijn cognitieve ontwikkelingsstoornissen. Het meeste onderzoek aan CAMK2 wordt echter gedaan bij volwassen dieren en bij de volwassen hersenen. We hebben verschillende muismodellen gegenereerd waarmee we het CAMK2A gen kunnen aan- of uitschakelen op specifieke tijdstippen en zelfs in specifieke hersengebieden, en we gebruiken deze muizen om de rol van CAMK2 in de hersenen te bestuderen (Achterberg, K J Neurosci, 2014; Kool, Sci Rep, 2016).
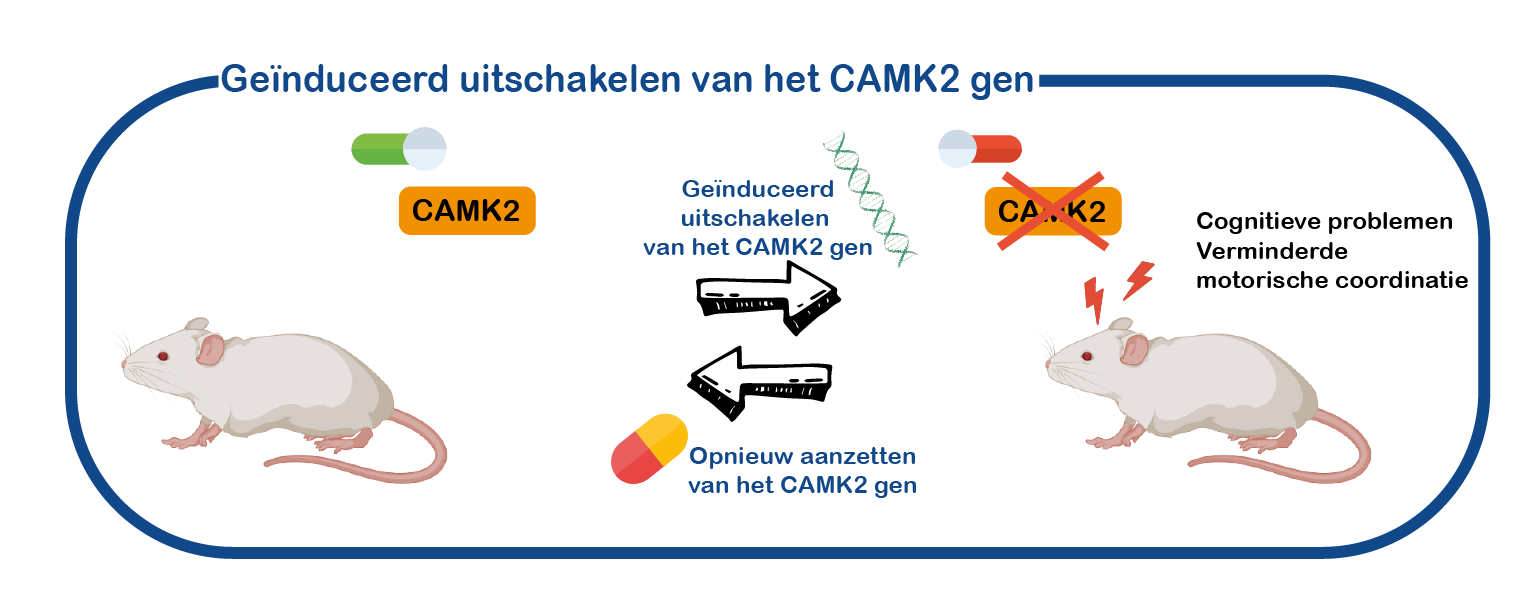
Met behulp van deze muismodellen onderzoeken we de rol van CAMK2 in de ontwikkeling van de hersenen. We gebruiken deze muizen ook om te testen of de afwezigheid van CAMK2 is en om medicijnen te testen.
De rol van CAMK2G en CAMK2D bij cognitieve ontwikkeling.
Onlangs hebben we 2 niet-verwante individuen geïdentificeerd met een cognitieve ontwikkelingsachterstand die een mutatie in het CAMK2G gen dragen (CAMK2Gp.R292P; (Proietti Onori, Hum Mutat, 2018)). Gebruikmakend van een CAMK2G-muismodel, waarbij het gen tijdens de ontwikkeling wordt uitgeschakeld, maar op elk gewenst moment kan worden ingeschakeld, kunnen we de neurologische gedragsfenotypes beoordelen, inclusief hun omkeerbaarheid tijdens de ontwikkeling. Nu er ook patiënten zijn geïdentificeerd die mutaties in CAMK2D dragen, is een vergelijkbare onderzoeksstrategie gepland voor CAMK2D. Deze experimenten zijn een eerste stap om de rol van de verschillende CAMK2’s bij de ontwikkeling van de hersenen te begrijpen.
Onderzoek aan menselijke neuronen.
Naast het gebruik van muismodellen gebruiken we ook geïnduceerde pluripotente stamcellen (iPS). Deze stamcellen worden gegenereerd uit bloedcellen die zijn gedoneerd door patiënten en niet-aangedane familieleden. Het grote voordeel van dergelijke iPS-cellen is dat we deze cellen kunnen differentiëren tot menselijke neuronen, waardoor we menselijke (patiënt) neuronen in een kweekschaal kunnen bestuderen. Met deze benadering hopen we te ontcijferen hoe de CAMK2 mutaties de hersenen ontregelen en om nieuwe geneesmiddelen te identificeren die de hersencel functie herstelt.
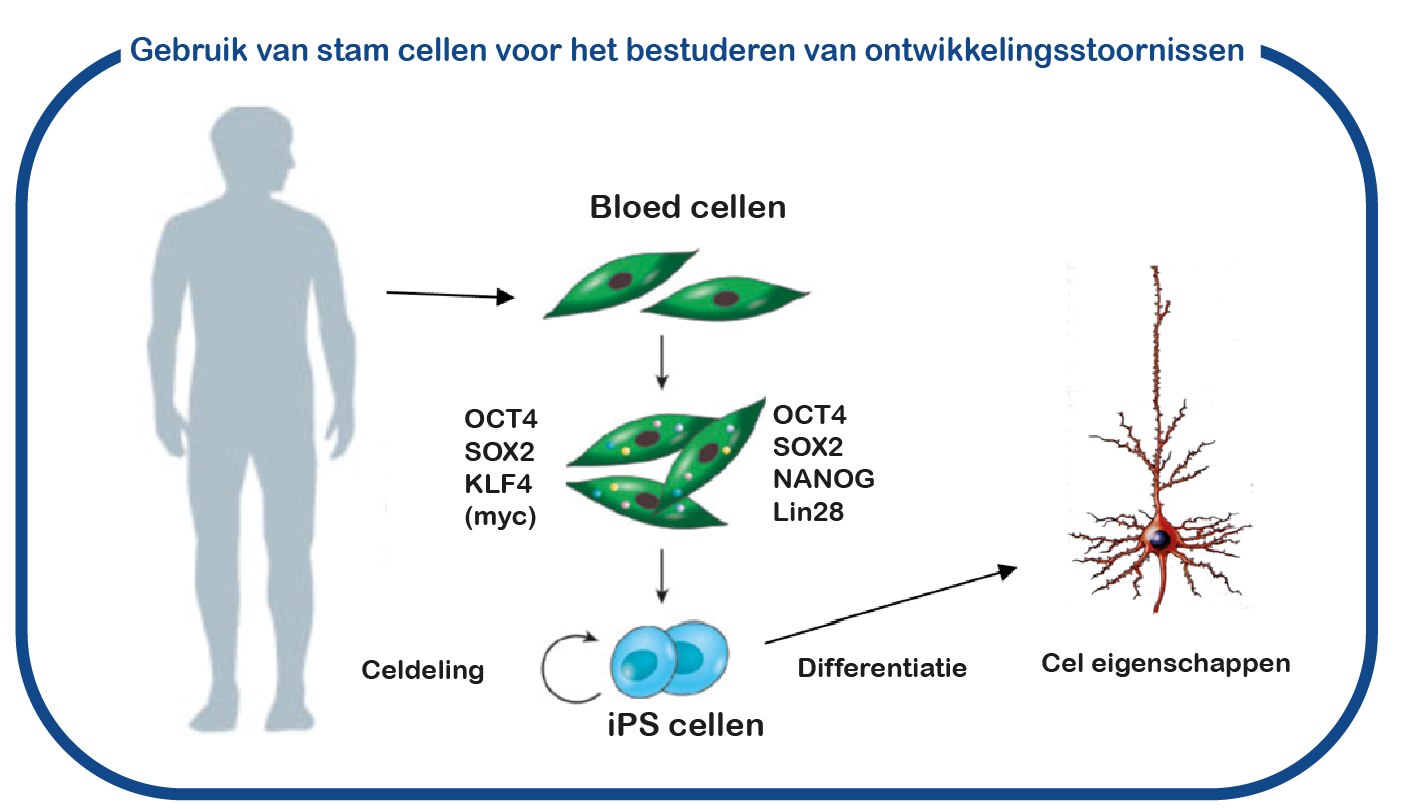
Inzicht in het effect van nieuwe varianten in de CAMK2-genen.
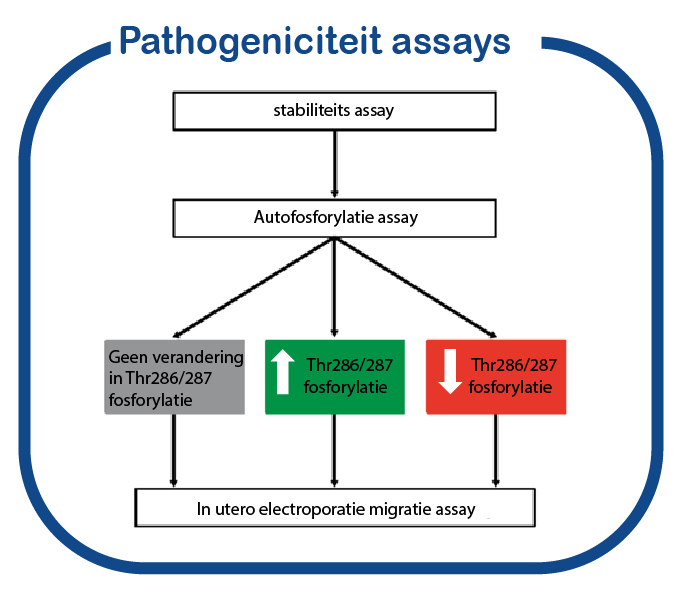
In de CAMK2 genen worden momenteel veel nieuwe mutaties geïdentificeerd. Voor een aantal van deze mutaties is het (eventuele) effect op de eiwitfunctie onbekend. Gebruikmakend van een functionele test die we de afgelopen jaren hebben ontwikkeld, PRiSM (Pipeline of Rapid in silico, in vivo and in vitro Screening of Mutations; functional genomics.nl, hebben we een platform gecreëerd om de pathogeniteit te onderzoeken van mutaties die gevonden zijn in CAMK2 en de eiwitten waarop ze effect hebben, bij personen met een cognitieve ontwikkelingsstoornis.
CAMK2A bestaat uit vier verschillende domeinen: een katalytisch domein, noodzakelijk voor de CAMK2-kinaseactiviteit, een regulerend domein waarin de bindingsplaats voor calcium-calmoduline ligt en het “zelf-remmende” domein, inclusief de Thr286-fosforyleringsplaats. Deze specifieke structuur is van cruciaal belang voor zijn rol als geheugenmolecuul. Wanneer neuronen met elkaar communiceren, komt calcium de cel binnen. Dit calciumsignaal is erg kort, maar zal worden vertaald in een langdurig signaal door de activering en autofosforylering van CAMK2: calcium bindt CAMK2 en deze binding resulteert in een verandering van de vouwing van CAMK2. Dit maakt het kinasedomein vrij van het regulerende domein en maakt een proces mogelijk dat autofosforylering wordt genoemd, waarbij een actieve CAMK2-subeenheid een fosfaatgroep kan plaatsen op het nu beschikbare T286-aminozuur van CAMK2. Wanneer de calciumspiegels in de cel weer dalen, komt calcium vrij uit CAMK2 en zal CAMK2 actief blijven dankzij de fosfaatgroep die op het T286- aminozuur is geplaatst. Dit proces is essentieel voor geheugenvorming.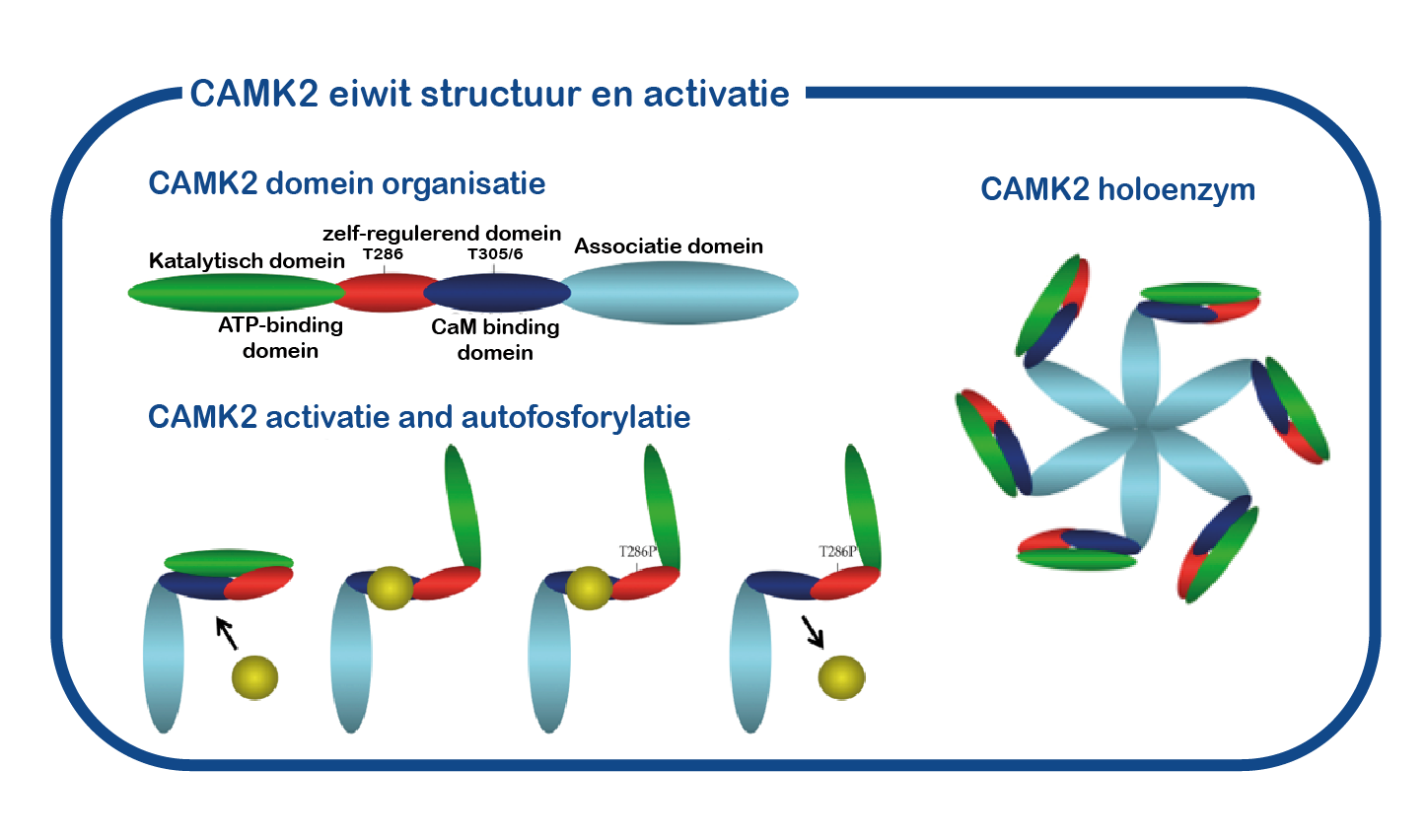
Rigter PMF, et.al. (2024) Role of CAMK2D in neurodevelopment and associated conditions. Am J Hum Genet. Pubmed
Rigter PMF, de Konink C, van Woerden GM. (2023). Loss of CAMK2G affects intrinsic and motor behavior but has minimal impact on cognitive behavior. Front Neurosci. Jan 6;16:1086994. Pubmed
Rigter PMF, et.al. (2022) Adult Camk2a gene reinstatement restores the learning and plasticity deficits of Camk2a knockout mice. Pubmed
Dwyer BK, et.al. (2022) Case Report: Developmental Delay and Acute Neuropsychiatric Episodes Associated With a de novo Mutation in the CAMK2B Gene (c.328G>A p.Glu110Lys) Front Pharmacol. 10;13:794008 Pubmed
Onori MP & van Woerden GM. (2021) Role of calcium/calmodulin-dependent kinase 2 in neurodevelopmental disorders. Brain Res Bull. S0361-9230(21)00090-3 Pubmed
Moro A, et.al. (2020) CaMKll controls neuromodulation via neuropeptide gene expression and axonal targeting of neuropeptide vesicles. PLoS Biol. Pubmed
Kool MJ, et al. (2019) CAMK2-dependent signaling in neurons is essential for survival. J Neurosci. 39; 5424–39. Pubmed
Vargas JY, et al. (2019) The Wnt/Ca 2+ pathway is involved in interneuronal communication mediated by tunneling nanotubes. EMBO J. Pubmed
Onori MP, et al. (2018) The intellectual disability-associated CAMK2G p.Arg292Pro mutation acts as a pathogenic gain-of-function. Hum Mutat. 39; 2008–24. Pubmed
Küry S, et al. (2017) De Novo Mutations in Protein Kinase Genes CAMK2A and CAMK2B Cause Intellectual Disability. Am J Hum Genet. 101; 768–88. Pubmed
Kool MJ, et.al. (2016) The molecular, temporal and region-specific requirements of the beta isoform of Calcium/Calmodulin-dependent protein kinase type 2 (CAMK2B) in mouse locomotion. Sci Rep. Pubmed
Achterberg KG, et al. (2014) Temporal and region-specific requirements of αCaMKII in spatial and contextual learning. J Neurosci. 34; 11180–7. Pubmed
Woerden G, et.al. (2009) betaCaMKll controls the direction of plasticity at parallel fiber-Purkinje cell synapses. Nat Neurosci. 12(7); 823-5. Pubmed
Hojjati M, et.al. (2007) Kinase activity is not required for alphaCaMKll-dependent presynaptic plasticity at CA3-CA1 synapses. Nat Neurosci. 10(9); 1125-7. Pubmed
Hansel C, et.al. (2006) alphaCaMKll is essential for cerebellar LTD and motor learning. Neuron. 51(6); 835-43. Pubmed
Elgersma Y, et.al. (2004) Mouse genetic approaches to investigating calcium/calmodulin-dependent protein kinase ll function in plasticity and cognition. J Neurosci. 24(39); 8410-5. Pubmed
Elgersma Y, et.al. (2002) Inhibitory autophosphorylation of CaMKll controls PSD association, plasticity and learning. Neuron. 36(3); 493-505. Pubmed
