Fragiele X Syndroom is een van de belangrijkste genetische oorzaken van verstandelijke beperking en autisme, en genoemd naar de afwijkende (‘fragiele’) vorm van het X-chromosoom bij deze individuen.
Fragiele X-syndroom wordt veroorzaakt door het ontbreken van het fragiele X mentale retardatie-eiwit (FMRP), als gevolg van een (200 +) expansie van de trinucleotide (CGG) herhaling aan het begin van het fragiele X mentale retardatie 1-gen (FMR1). Dit veroorzaakt het verlies van FMRP-eiwit.
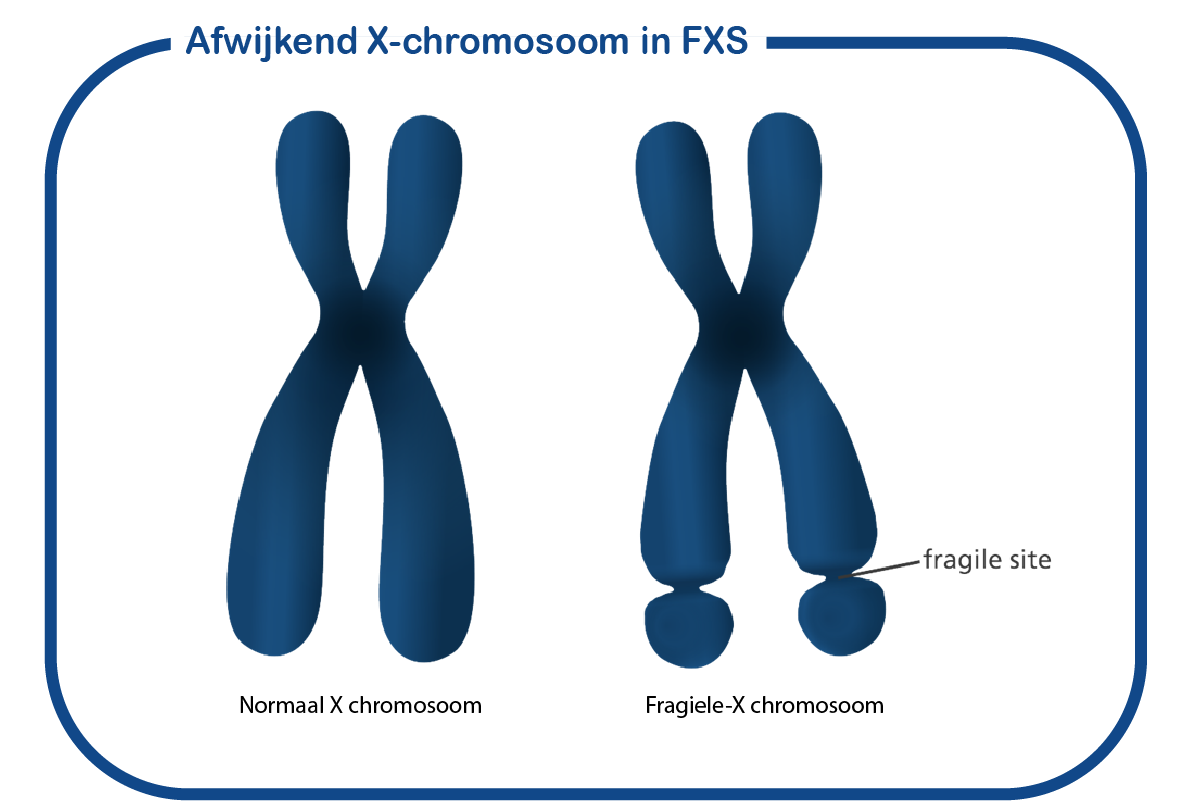
Het Fragiele X-gen werd geïdentificeerd in het Erasmus MC (Verkerk, Cell, 1991). Het Fragiele X-gen codeert voor een eiwit dat FMRP1 (Fragile X Mental Retardation Protein) wordt genoemd. Dit eiwit bindt mRNA, dat cruciaal is bij de regulatie van de eiwitsynthese na stimulatie van metabotrope glutamaat receptoren (mGluR’s) in synapsen. Activering van deze receptoren, vooral de mGluR5-receptor, leidt tot lokale vertaling (translatie) van specifieke mRNA’s in eiwitten. Aangenomen wordt dat FMRP een belangrijke rol speelt bij de translatie van deze mRNA’s, en dat verlies van FMRP resulteert in overmatige eiwitsynthese.
Fragiele X-geassocieerd tremor / ataxiesyndroom (FXTAS) is een laat optredende neurodegeneratieve aandoening die bij sommige individuen tremor, ataxie, hersenpathologie, cognitief verlies, dementie en vroegtijdig overlijden veroorzaakt. Net als bij het Fragiele X Syndrome dragen deze individuen een mutatie in het FMR1-gen. Maar in dit geval betreft het een Fragiele X-pre-mutatie (een CGG-herhaling van 50-200 kopieën). In tegenstelling tot het Fragiele X Syndrome, wordt verondersteld dat FXTAS wordt veroorzaakt door een ‘gain-of-function’-mechanisme, d.w.z. de pre-mutatie geeft niet aanleiding tot verlies van een eiwit maar resulteert in een toxisch eiwit. Een kenmerk van FXTAS-neuropathologie in postmortaal hersenweefsel is de aanwezigheid van ubiquitine-positieve intranucleaire aggregaten in zowel neuronen als astrocyten.
Het eerste muismodel van het Fragiele X Syndroom is gegenereerd op de afdeling Klinische Genetica, Erasmus MC. Met behulp van gedragsexperimenten en moleculair en morfologisch onderzoek in zowel Fmr1-muizen als gekweekte primaire neuronen uit humane stamcellen ( iPSC’s), hopen we therapeutische interventies te identificeren. Sociaal gedrag van Fmr1 knock-out muizen is daarbij de primaire uitkomstmaat in deze preklinische muisstudies. Daarnaast worden nieuwe strategieën verkend met combinatietherapie. Ontwikkeling en evaluatie van succesvolle therapeutische interventiestrategieën (medicijnen, combinatietherapie) uit ons preklinische werk kan leiden tot nieuwe klinische trials bij ENCORE bij patiënten met het Fragiele X Syndroom..
Voor FXTAS-onderzoek is het nodig om kritieke leeftijden te definiëren wanneer pathologie begint, en de ziekte kan worden gestopt, en de cellulaire en moleculaire mechanismen identificeren die kunnen dienen als therapeutische doelen voor patiënten met FXTAS. Om aan deze belangrijke behoeften te voldoen, hebben we krachtige state-of-the-art in vitro en in vivo modellen van FXTAS ontwikkeld, waaronder primaire neuronen, muis- en zebravis modellen.
Müller AR, et.al. (2024) Cannabidiol (Epidyolex®) for severe behavioral manifestations in patients with tuberous sclerosis complex, mucopolysaccharidosis type III and fragile X syndrome: protocol for a series of randomized, placebo-controlled N-of-1 trials. BMC Psychiatry. Pubmed
Lubbers K, et.al. (2022) Autism Symptoms in Children and Young Adults With Fragile X Syndrome, Angelman Syndrome, Tuberous Sclerosis Complex, and Neurofibromatosis Type 1: A Cross-Syndrome Comparison. Front Psychiatry. Pubmed
Ottenhoff MJ, et.al. (2020) Considerations for Clinical Therapeutic Development of Statins for Neurodevelopmental Disorders. eNeuro. 7; 1-5. Pubmed
Van Remmerden MC, et al. (2020) Growing up with Fragile X Syndrome: Concerns and Care Needs of Young Adult Patients and Their Parents. J Autism Dev Disord. Pubmed
Zeidler S, et.al.(2018) Fragile X Syndrome: new therapeutic strategies. Tijdschr Psychiatr. 60(5); 338-42 Link
Zeidler S, et.al. (2017) Leidraad voor diagnostiek en behandeling van kinderen met het Fragiele X Syndroom. Expertisecentrum ENCORE. Link
van der Vaart T, et.al. (2015) Treatment of Cognitive Deficits in Genetic Disorders: A Systematic Review of Clinical Trials of Diet and Drug Treatments. JAMA Neurol 72; 1052–60. Pubmed
Pop, A.S. et al. (2013) Fragile X syndrome: a preclinical review on metabotropic glutamate receptor 5 (mGluR5) antagonists and drug development. Psychopharmacology (Berl.) Pubmed
de Esch, C.E.F. et al. (2013) Translational endpoints in fragile X syndrome. Neurosci Biobehav Rev. Pubmed
Pop, A.S. et al. (2012) Rescue of dendritic spine phenotype in Fmr1 KO mice with the mGluR5 antagonist AFQ056/Mavoglurant. Psychopharmacology (Berl.) Pubmed
Vinueza Veloz, M.F. et al. (2012) The effect of an mGluR5 inhibitor on procedural memory and avoidance discrimination impairments in Fmr1 KO mice. Genes Brain Behav 11, 325–331. Pubmed
Castrén, E. et al. (2012) Treatment of neurodevelopmental disorders in adulthood. J Neurosci 32, 14074–14079. Link
Levenga, J. et al. (2011) AFQ056, a new mGluR5 antagonist for treatment of fragile X syndrome. Neurobiol Dis 42, 311–317. Pubmed
Levenga, J. et al. (2011) Subregion-specific dendritic spine abnormalities in the hippocampus of Fmr1 KO mice. Neurobiol Learn Mem 95, 467–472. Pubmed
Levenga, J. et al. (2010) Potential therapeutic interventions for fragile X syndrome. Trends Mol Med 16, 516–527. Pubmed
Brouwer, J.R. et al. (2009) The FMR1 gene and fragile X-associated tremor/ataxia syndrome. Am. J. Med Genet B Neuropsychiatr Genet, 150, 782–798. Pubmed
Levenga, J. et al. (2009) Ultrastructural analysis of the functional domains in FMRP using primary hippocampal mouse neurons. Neurobiol Dis 35, 241–250. Pubmed
Van’t Padje, S. et al. (2009) Reduction in fragile X related 1 protein causes cardiomyopathy and muscular dystrophy in zebrafish. J. Exp. Biol. 212, 2564–2570. Pubmed
Brouwer, J.R. et al. (2008) CGG-repeat length and neuropathological and molecular correlates in a mouse model for fragile X-associated tremor/ataxia syndrome. J Neurochem 107, 1671–1682. Pubmed
Smit, A.E. et al. (2008) Savings and extinction of conditioned eyeblink responses in fragile X syndrome. Genes Brain Behav 7, 770–777. Pubmed
de Vrij, F.M.S. et al. (2008) Rescue of behavioral phenotype and neuronal protrusion morphology in Fmr1 KO mice. Neurobiol Dis 31, 127–132. Pubmed
Brouwer, J.R. et al. (2008) Altered hypothalamus-pituitary-adrenal gland axis regulation in the expanded CGG-repeat mouse model for fragile X-associated tremor/ataxia syndrome. Psychoneuroendocrinology 33, 863–873. Pubmed
Govaerts, L.C.P. et al. (2007) Exceptional good cognitive and phenotypic profile in a male carrying a mosaic mutation in the FMR1 gene. Clin Genet 72, 138–144. Pubmed
Brouwer, J.R. et al. (2007) Elevated Fmr1 mRNA levels and reduced protein expression in a mouse model with an unmethylated Fragile X full mutation. Exp Cell Res 313, 244–253. Pubmed
Mientjes, E.J. et al. (2006) The generation of a conditional Fmr1 knock out mouse model to study Fmrp function in vivo. Neurobiol Dis 21, 549–555. Pubmed
Koekkoek, S.K.E. et al. (2005) Deletion of FMR1 in Purkinje cells enhances parallel fiber LTD, enlarges spines, and attenuates cerebellar eyelid conditioning in Fragile X syndrome. Neuron 47, 339–352. Pubmed
van ’t Padje, S. et al. (2005) Characterisation of Fmrp in zebrafish: evolutionary dynamics of the fmr1 gene. Dev. Genes Evol. 215, 198–206. Pubmed
Blonden, L. et al. (2005) Two members of the Fxr gene family, Fmr1 and Fxr1, are differentially expressed in Xenopus tropicalis. Int. J. Dev. Biol. 49, 437–441. Pubmed
Stoyanova, V. et al. (2004) Loss of FMR1 hypermethylation in somatic cell heterokaryons. FASEB J. 18, 1964–1966. Pubmed
Schrier, M. et al. (2004) Transport kinetics of FMRP containing the I304N mutation of severe fragile X syndrome in neurites of living rat PC12 cells. Exp Neurol 189, 343–353. Pubmed
Mientjes, E.J. et al. (2004) Fxr1 knockout mice show a striated muscle phenotype: implications for Fxr1p function in vivo. Hum Mol Genet 13, 1291–1302. Pubmed
De Diego Otero, Y. et al. (2002) Transport of fragile X mental retardation protein via granules in neurites of PC12 cells. Mol Cell Biol 22, 8332–8341. Pubmed
Willemsen, R. et al. (2002) Timing of the absence of FMR1 expression in full mutation chorionic villi. Hum Genet 110, 601–605. Pubmed
Bontekoe, C.J.M. et al. (2002) Knockout mouse model for Fxr2: a model for mental retardation. Hum Mol Genet 11, 487–498. Pubmed
Bontekoe, C.J. et al. (2001) Instability of a (CGG)98 repeat in the Fmr1 promoter. Hum Mol Genet 10, 1693–1699. Pubmed
Willemsen, R. et al. (2000) Twin sisters, monozygotic with the fragile X mutation, but with a different phenotype. J Med Genet 37, 603–604. Pubmed
Bakker, C.E. et al. (2000) Immunocytochemical and biochemical characterization of FMRP, FXR1P, and FXR2P in the mouse. Exp Cell Res 258, 162–170. Pubmed
Tamanini, F. et al. (2000) The fragile X-related proteins FXR1P and FXR2P contain a functional nucleolar-targeting signal equivalent to the HIV-1 regulatory proteins. Hum Mol Genet 9, 1487–1493. Pubmed
Willemsen, R. et al. (1999) Noninvasive test for fragile X syndrome, using hair root analysis. Am J Hum Genet 65, 98–103. Pubmed
de Vries, B.B. et al. (1999) Screening for the fragile X syndrome among the mentally retarded: a clinical study. The Collaborative Fragile X Study Group. J Med Genet 36, 467–470. Pubmed
Tamanini, F. et al. (1999) Different targets for the fragile X-related proteins revealed by their distinct nuclear localizations. Hum Mol Genet 8, 863–869. Pubmed
de Vries, B.B. et al. (1999) Dilemmas in counselling females with the fragile X syndrome. J Med Genet 36, 167–170. Pubmed
Wildhagen, M.F. et al. (1999) Efficacy of cascade testing for fragile X syndrome. J Med Screen 6, 70–76. Pubmed
de Vries, B.B. et al. (1998) Screening with the FMR1 protein test among mentally retarded males. Hum Genet 103, 520–522. Pubmed
Verheij, C. et al. (1993) Characterization and localization of the FMR-1 gene product associated with fragile X syndrome. Nature 363, 722–724. Pubmed
Reyniers, E. et al. (1993) The full mutation in the FMR-1 gene of male fragile X patients is absent in their sperm. Nat Genet 4, 143–146. Pubmed
Verkerk, A.J. et al. (1993) Alternative splicing in the fragile X gene FMR1. Hum Mol Genet 2, 399–404. Pubmed
De Boulle, K. et al. (1993) A point mutation in the FMR-1 gene associated with fragile X mental retardation. Nat Genet 3, 31–35. Pubmed
de Vries, B.B. et al. (1993) Mental status and fragile X expression in relation to FMR-1 gene mutation. Eur J Hum Genet 1, 72–79. Pubmed
Willems, P.J. et al. (1992) Segregation of the fragile X mutation from an affected male to his normal daughter. Hum Mol Genet 1, 511–515. Pubmed
Verkerk, A.J. et al. (1992) Intragenic probe used for diagnostics in fragile X families. Am J Med Genet 43, 192–196. Pubmed
Oostra, B.A. and Verkerk, A.J. (1992) The fragile X syndrome: isolation of the FMR-1 gene and characterization of the fragile X mutation. Chromosoma 101, 381–387. Pubmed
Faust, C.J. et al. (1992) Genetic mapping on the mouse X chromosome of human cDNA clones for the fragile X and Hunter syndromes. Genomics 12, 814–817. Pubmed
Verkerk, A.J. et al. (1991) Identification of a gene (FMR-1) containing a CGG repeat coincident with a breakpoint cluster region exhibiting length variation in fragile X syndrome. Cell 65, 905–914. Pubmed
