Neurofibromatose type 1 (NF1) is een autosomaal dominante genetische aandoening die wordt veroorzaakt door een functieverlies van een van de twee kopieën van het NF1-gen. NF1 heeft een geboorte-incidentie van ongeveer 1: 2000. De inactivatie van het NF1-gen kan verschillende symptomen veroorzaken die de huid, het bot en het zenuwstelsel aantasten. NF1 wordt ook geassocieerd met een verhoogd risico op goedaardige en kwaadaardige tumorvorming. Daarnaast wordt NF1 vaak geassocieerd met cognitieve beperkingen. Deze cognitieve gebreken omvatten problemen met aandacht, visueel-ruimtelijke vaardigheden, motorisch leren, en lager IQ (Krab, The Journal of Pediatrics, 2009, 2008).
NF1 cognitief onderzoek.
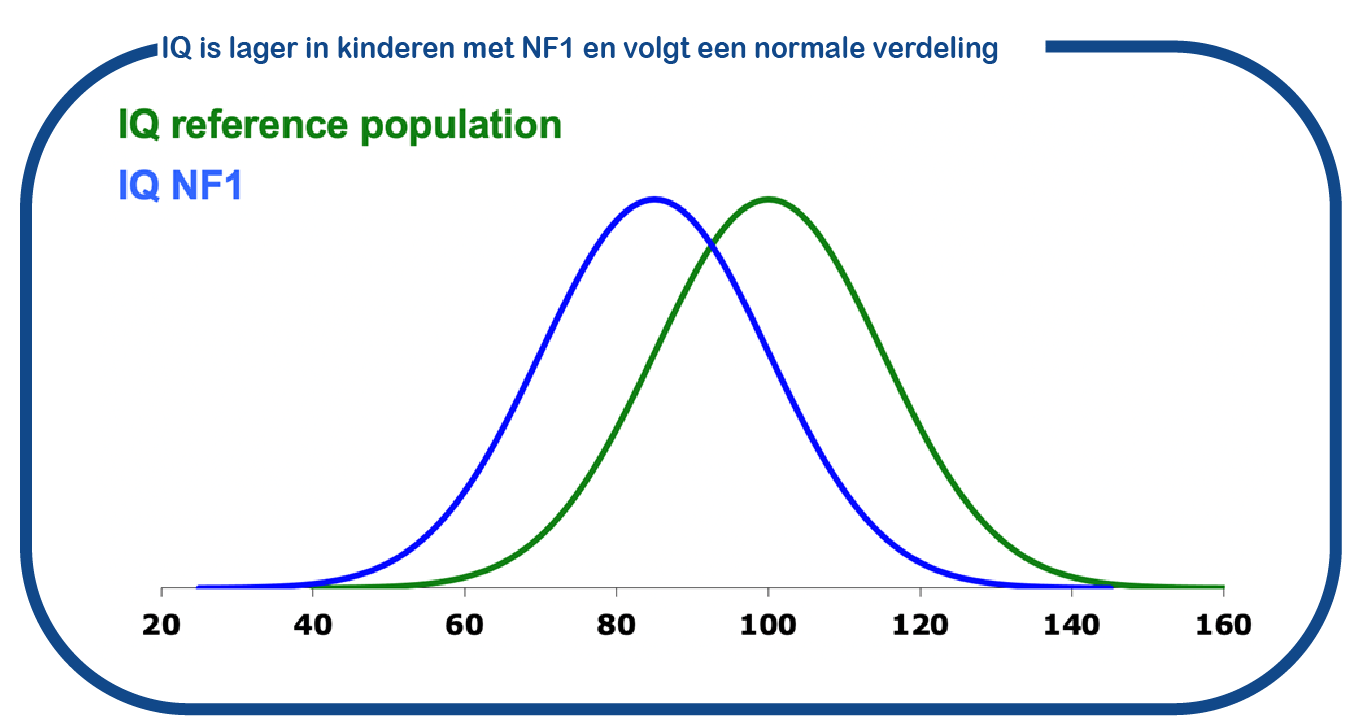
Het NF1 ENCORE Expertisecentrum van het Erasmus MC heeft een lange geschiedenis van onderzoek naar de cognitieve problemen die samenhangen met NF1. Onlangs hebben we in een onderzoek van 500 kinderen aangetoond dat het gemiddelde intelligentiequotiënt van kinderen met NF1 naar links is verschoven (gemiddeld IQ 88), maar dat de variabiliteit in cognitieve vaardigheden vergelijkbaar is met die van de algemene bevolking (Ottenhoff, Genet Med , 2020). Dit geeft aan dat de aanwezigheid van de NF1-mutatie, het IQ met ongeveer 12 punten beïnvloedt, ongeacht het type mutatie in NF1. Alleen bij NF1-individuen met een chromosomale deletie is deze verschuiving significant groter. Ons onderzoek geeft ook aan dat er geen belangrijke rol is weggelegd voor zogenaamde ‘modificerende genen’ die mogelijk het effect van NF1 op de hersenfunctie kunnen veranderen.
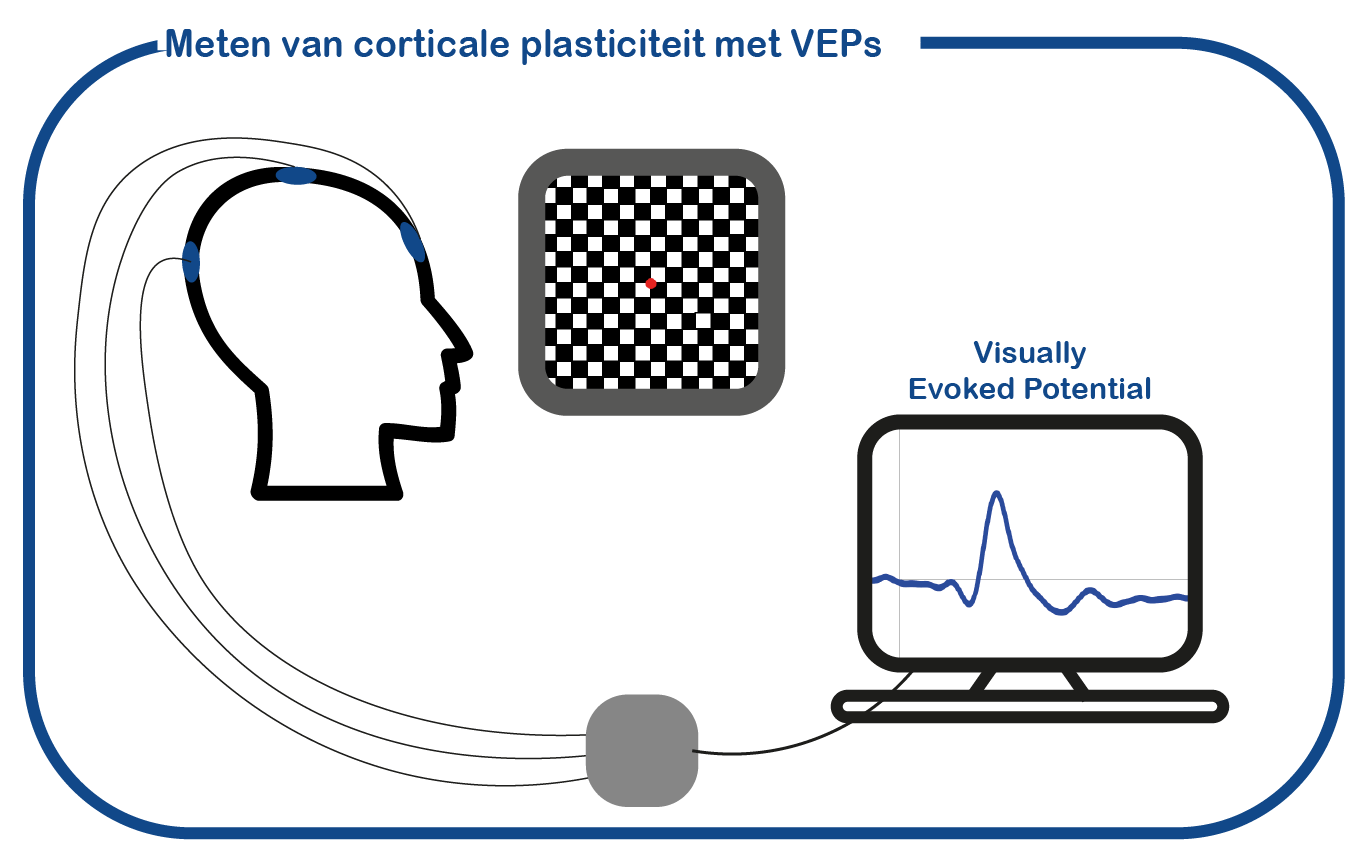
Studies naar het cellulaire mechanisme dat ten grondslag ligt aan de cognitieve problemen bij NF1, zijn grotendeels gericht op diermodellen van NF1. Op basis van deze muis onderzoeken is aangetoond dat de cognitieve problemen het gevolg zijn van een verhoogde activiteit van remmende interneuronen die de synaptische plasticiteit verminderen. Of deze veranderingen in de plasticiteit ook ten grondslag liggen aan de cognitieve gebreken bij NF1-patiënten is onbekend. Om de rol van corticale plasticiteit en inhibitie bij volwassenen met NF1 te onderzoeken, gebruiken we niet-invasieve neurofysiologische meetmethoden zoals transcraniële magnetische stimulatie (TMS) en elektro-encefalografie (EEG).
Ondanks de verschillende klinische trials die uitgevoerd zijn om de cognitieve probelemen bij NF1 te verminderen, zijn we er nog niet in geslaagd een effectieve behandeling te identificeren. Statines verbeterden de neuronale plasticiteit en leerachterstanden in een Nf1-muismodel, maar het had geen effect op de cognitieve functie, aandacht en gedrag bij NF1-kinderen (Krab, The Journal of the American Medical Association (JAMA), 2008; Van de Vaart, The Lancet Neurology, 2013). Onlangs heeft het ENCORE-laboratorium aangetoond dat de cognitieve gebreken bij Nf1-muizen mede veroorzaakt worden door een verminderde functie van HCN1-kanalen (Omrani, Molecular Psychiatry, 2015). Een agonist (stimulator) van het HCN1-kanaal, lamotrigine, kan dit probleem bij muizen opheffen. Of dit ook bij mensen het geval is, wordt momenteel onderzocht door middel van een gerandomiseerde gecontroleerde trial.
Lopende klinische studies.
VEP-NF1-studie: om plasticiteit in de visuele cortex bij NF1-patiënten te onderzoeken, meten we visuele evoked potentials (VEP’s) als reactie op visuele stimulatie. Om het vermogen van het visuele systeem om acties uit te voeren te bestuderen, beoordelen we bovendien oog- en hand bewegingen tijdens specifieke coördinatietaken.
NF1 Tumor-gerelateerd onderzoek.
NF1-patiënten zijn vatbaar voor het ontwikkelen van kanker. Bijna alle personen met NF1 vertonen goedaardige neurofibromen op de huid, die voorkomen uit vergroeiingen van perifere zenuwen. Velen ontwikkelen ook dieper zittende plexiforme neurofibromen die, via intermediaire, atypische neurofibromen kunnen transformeren in kwaadaardige perifere zenuwmanteltumoren (MPNST). NF1-patiënten hebben een kans van 8 – 16% om een MPNST in hun leven te ontwikkelen, wat een belangrijke doodsoorzaak is bij deze patiëntengroep. MPNST zijn agressieve sarcomen die gemakkelijk uitzaaien en therapieresistent zijn, wat zich vertaalt in een slechte prognose, vooral voor die patiënten in een gevorderd stadium van de ziekte. Op de afdeling Medische oncologie, Erasmus MC, worden de moleculaire mechanismen die ten grondslag liggen aan de kwaadaardige transformatie van plexiforme neurofibromen naar MPNST bestudeerd met een bijzondere interesse voor microRNA’s. We hebben aangetoond dat ontregelde microRNA’s in MPNST bijdragen aan tumor gerelateerde processen, zoals het vermogen om omringend weefsel binnen te dringen en te metastaseren (Amirnasr, Scientific Reports, 2020). Een beter begrip van de precieze betrokkenheid van microRNA’s bij het ontstaan van MPNST – en atypische neurofibromen en plexiforme neurofibromen – kan nieuwe, effectievere, therapeutische strategieën opleveren. Een ander onderzoeksdoel is om biomarkers te identificeren, (zoals microRNA’s in het bloed van de NF1-patiënt) die de ontwikkeling van MPNST signaleert en klinische interventie in een vroeg stadium mogelijk maken.
Dhaenens BAE, et.al. (2024) The PlexiQoL, a patient-reported outcome measure on quality of life in neurofibromatosis type 1-associated plexiform neurofibroma: translation, cultural adaptation and validation into the Dutch language for the Netherlands. J Patient Rep Outcomes. Pubmed
Bennebroek CA, et.al. (2023) Treatment evaluation by volumetric segmentation in pediatric optic pathway glioma: evaluation of the effect of bevacizumab on intra-tumor components. J Neurooncol. Pubmed
Taal W, et.al. (2023) Symptomatische tumoren bij neurofibromatose type 1 Symptomatic tumors in neurofibromatosis type 1: a diagnostic challenge. Ned Tijdschr Geneeskd. Pubmed
Dhaenens BAE, et.al. (2023) Health-related quality of life of children with neurofibromatosis type 1: Analysis of proxy-rated PedsQL and CHQ questionnaires. Eur J Paediatr Neurol. Pubmed
Carton C, et.al. (2023) ERN GENTURIS NF1 Tumour Management Guideline Group. ERN GENTURIS tumour surveillance guidelines for individuals with neurofibromatosis type 1. Pubmed
Castricum J, et.al. (2023) Visual-spatial and visuomotor functioning in adults with neurofibromatosis type 1. J Intellect Disabil Res. Pubmed
Ottenhoff MJ, et.al. (2022) Cerebellum-dependent associative learning is not impaired in a mouse model of neurofibromatosis type 1. Sci Rep. Nov 9;12(1):19041. Pubmed
Douben HCW, et.al. (2022) High-yield identification of pathogenic NF1 variants in skin fibroblast transcriptome screening after apparently normal diagnostic DNA testing. Hum Mutat. Pubmed
Castricum J, et.al. (2022) Plasticity of visual evoked potentials in patients with neurofibromatosis type 1. Clin Neurophysiol. Pubmed
Lubbers K, et.al. (2022) Autism Symptoms in Children and Young Adults With Fragile X Syndrome, Angelman Syndrome, Tuberous Sclerosis Complex, and Neurofibromatosis Type 1: A Cross-Syndrome Comparison. Front Psychiatry. Pubmed
Dhaenens BAE, et.al. (2021) Lessons learned from drug trials in neurofibromatosis: A systematic review. Eur J Med Genet. 2021 Jul 5:104281. Pubmed
Castricum J, Tulen JHM, Taal W, Rietman AB, Elgersma Y (2021). Attention and Motor Learning in Adult Patients with Neurofibromatosis Type 1. J Atten Disord. Pubmed
Dhaenens BAE, et.al. (2021). Identifying challenges in neurofibromatosis: a modified Delphi procedure. Eur J Hum Genet. 26:1–9 Pubmed
Fangusaro J, et.al. (2020) Response assessment in paediatric low-grade glioma: recommendations from the Response Assessment in Pediatric Neuro-Oncology (RAPNO) working group. Lancet Oncol. 21(6); e305-16. Pubmed
Amirnasr A, et.al. (2020) Deregulated microRNAs in neurofibromatosis type 1 derived malignant peripheral nerve sheet tumors. Sci. Rep. 10:2927. Pubmed
Castricum J, et.al. (2020) Motor cortical excitability and plasticity in patients with neurofibromatosis type 1. Clin Neurophysiol. 131(11); 2673-81. Pubmed
Ottenhoff MJ, et al.(2020) Examination of the genetic factors underlying the cognitive variability associated with neurofibromatosis type 1. Genet Med.1-9. Pubmed
Frebourg T, et.al. (2020) Guidelines for the Li-Fraumeni and heritable TP53 related cancer syndromes. Eur J Hum Genet. 28(10); 1379-86. Pubmed
Siebelt M, et al. (2019) Congenital Forearm Pseudarthrosis, a Systematic Review for a Treatment Algorithm on a Rare Condition. J Pediatr Orthop. 40; e367-74. Pubmed
Vos JR, et.al. (2019) Boosting care and knowledge about hereditary cancer: European Reference Network on Genetic Tumour Risk Syndromes. Fam Cancer. 18(2); 281-4. Pubmed
Koczkowska M, et.al. (2019) Expanding the clinical phenotype of individuals with a 3-bp in-frame deletion of the NF1 gene (c.2970_2972del): an update of genotype-phenotype correlation. Genet. Med. 21(4); 867-76. Pubmed
Rietman AB, et al. (2018) Emotional and behavioral problems in children and adolescents with neurofibromatosis type 1. Am J Med Genet B Neuropsychiatr Genet. 177; 319–28. Pubmed
Rietman AB, et al. (2018) Worries and needs of adults and parents of adults with neurofibromatosis type 1. Am J Med Genet A. 176; 1150–60. Pubmed
Eijk S, et al. (2018) Autism Spectrum Disorder in an Unselected Cohort of Children with Neurofibromatosis Type 1 (NF1). J Autism Dev Disord. 48; 2278–85. Pubmed
Amirnasr A, et.al. (2017) Expression and inhibition of BRD4, EZH2 and TOP2A in neurofibromas and malignant peripheral nerve sheath tumors. PLoS One. 12(8); e0183155. Pubmed
Rietman AB, et al. (2017) Development of emotional and behavioral problems in neurofibromatosis type 1 during young childhood. Am J Med Genet A. 173; 2373–80. Pubmed
Rietman AB, et al. (2017) Motor problems in children with neurofibromatosis type 1. J Neurodev Disord. Pubmed
van der Vaart T, et al. (2016) Behavioral and cognitive outcomes for clinical trials in children with neurofibromatosis type 1. Neurology 86;154–60. Pubmed
Omrani A, et al. (2015) HCN channels are a novel therapeutic target for cognitive dysfunction in Neurofibromatosis type 1. Mol Psychiatry 20; 1311–21. Pubmed
Omrani A, et.al. (2015) Neurofibromin regulates HCN activity in Parvalbumin-positive interneurons. Mol Psychiatry. 20; 1263. Pubmed
Van Der Vaart, T. et al. (2013) Simvastatin for cognitive deficits and behavioural problems in patients with neurofibromatosis type 1 (NF1-SIMCODA): a randomised, placebo-controlled trial. Lancet Neurol 12, 1076–1083. Pubmed
van Minkelen, R. et al. (2013) A clinical and genetic overview of 18 years neurofibromatosis type 1 molecular diagnostics in the Netherlands. Clin Genet. Pubmed
Acosta, M.T. et al. (2012) The Learning Disabilities Network (LeaDNet): using neurofibromatosis type 1 (NF1) as a paradigm for translational research. Am J Med Genet A 158, 2225–2232. Pubmed
van der Vaart, T. et al. (2011) Motor deficits in neurofibromatosis type 1 mice: the role of the cerebellum. Genes Brain Behav 10, 404–409. Pubmed
Krab, L.C. et al. (2011) Motor learning in children with neurofibromatosis type I. Cerebellum 10, 14–21. Pubmed
Krab, L.C. et al. (2009) Health-related quality of life in children with neurofibromatosis type 1: contribution of demographic factors, disease-related factors, and behavior. J Pediatr 154, 420–5, 425.e1. Pubmed
Denayer, E. et al. (2008) Spred1 is required for synaptic plasticity and hippocampus-dependent learning. J Neurosci 28, 14443–14449. Pubmed
Cui, Y. et al. (2008) Neurofibromin regulation of ERK signaling modulates GABA release and learning. Cell 135, 549–560. Pubmed
Krab, L.C. et al. (2008) Impact of neurofibromatosis type 1 on school performance. J Child Neurol 23, 1002–1010. Pubmed
Krab, L.C. et al. (2008) Effect of simvastatin on cognitive functioning in children with neurofibromatosis type 1: a randomized controlled trial. JAMA 300, 287–294. Pubmed
Balgobind, B.V. et al. (2008) Leukemia-associated NF1 inactivation in patients with pediatric T-ALL and AML lacking evidence for neurofibromatosis. Blood 111, 4322–4328. Pubmed
van Engelen, S.J.P.M. et al. (2008) Quantitative differentiation between healthy and disordered brain matter in patients with neurofibromatosis type I using diffusion tensor imaging. AJNR Am J Neuroradiol 29, 816–822. Pubmed
Oostenbrink, R. et al. (2007) Parental reports of health-related quality of life in young children with neurofibromatosis type 1: influence of condition specific determinants. J Pediatr 151, 182–6– 186.e1–2. Pubmed
Cnossen, M.H. et al. (1998) Minor disease features in neurofibromatosis type 1 (NF1) and their possible value in diagnosis of NF1 in children. J Med Genet 35, 624–627. Pubmed
Cnossen, M.H. et al. (1998) A prospective 10 year follow up study of patients with neurofibromatosis type 1. Arch. Dis. Child. 78, 408–412. Pubmed
Cnossen, M.H. et al. (1997) Endocrinologic disorders and optic pathway gliomas in children with neurofibromatosis type 1. Pediatrics 100, 667–670. Pubmed
Cnossen, M.H. et al. (1997) Diagnostic delay in neurofibromatosis type 1. Eur J Pediatr 156, 482–487. Pubmed
Cnossen, M.H. et al. (1997) Deletions spanning the neurofibromatosis type 1 gene: implications for genotype-phenotype correlations in neurofibromatosis type 1? Hum Mutat 9, 458–464. Pubmed
