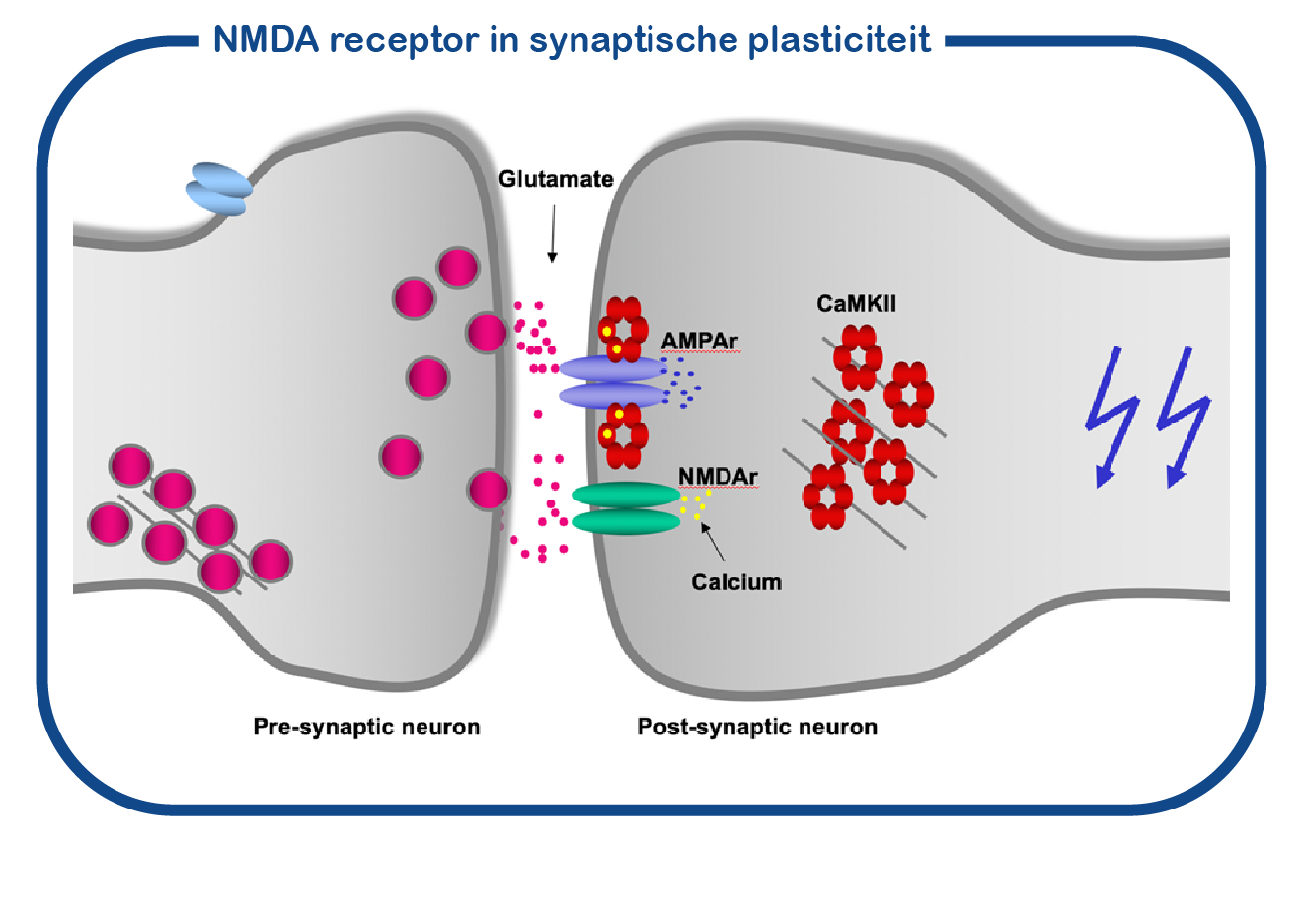
GRIN-aandoeningen worden veroorzaakt door mutaties in de GRIN1-, GRIN2A-, GRIN2B- of GRIN2D-genen. De GRIN-eiwitten behoren tot de familie van ionotrope glutamaatreceptoren, waartoe ook de GRIA-genen behoren. De GRIN-eiwitten vormen een kanaal dat NMDA-receptor wordt genoemd, de GRIA-genen coderen voor eiwitten die het AMPA-receptorkanaal vormen. De NMDA-receptor staat ook wel bekend als ‘coincidentie detector’: hij gaat alleen open als de presynaptische neuron (de zendende neuron) en de postsynaptische neuron (de ontvangende neuron) tegelijkertijd actief zijn. Wanneer dit tegelijk gebeurt (=coincidentie), gaat het NMDA-kanaal open en laat het calcium toe in de postsynaptische neuron. Calcium activeert het CAMK2-enzym, dat is gebonden aan de NMDA-receptor. Activering van CAMK2 veroorzaakt synaptische veranderingen. Dit proces is essentieel voor leren en geheugenvorming. CAMK2 syndroom is ook een onderdeel van ENCORE.
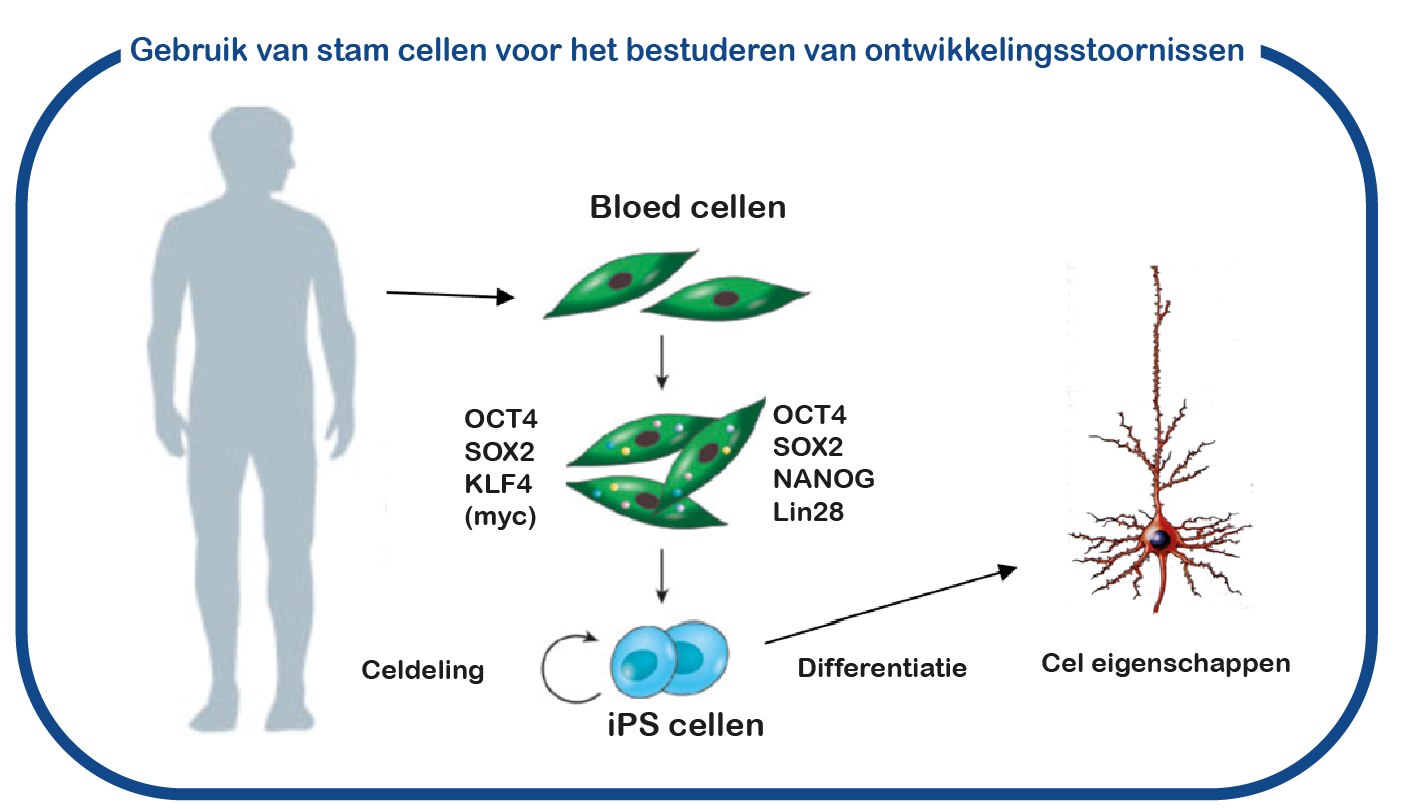
Hoewel ENCORE een lange geschiedenis heeft in het bestuderen van CAMK2-signalering (zie CAMK2-pagina op deze site), worden GRIN-aandoeningen pas recent bestudeerd. Daarvoor gebruiken we geïnduceerde pluripotente stamcellen (iPS). Deze stamcellen worden gegenereerd uit bloedcellen die zijn gedoneerd door patiënten en niet-aangedane familieleden. Het grote voordeel van dergelijke iPS-cellen is dat we deze cellen kunnen differentiëren tot menselijke neuronen, waardoor we menselijke (patiënt) neuronen in een kweekschaal kunnen bestuderen. Met deze benadering hopen we te ontcijferen hoe de gemuteerde GRIN-eiwitten de activiteit de hersenen ontregelen en om nieuwe geneesmiddelen te identificeren die de hersencel functie herstelt.