Om de best mogelijke zorg te verlenen aan patiënten met een zeldzame aandoening is het essentieel dat er wereldwijd kennis over de aandoening vergaard wordt. Om de zorg voor zeldzame aandoeningen en het vergaren van kennis te stimuleren zijn er landelijke expertisecentra opgezet. Voor de formele erkenning van een expertisecentrum door het ministerie van VWS, is een belangrijke voorwaarde dat het expertisecentrum kennis vergaart, analyseert en deelt door middel van publicaties. Dit kunnen publicaties zijn in wetenschappelijke tijdschriften, maar ook behandel richtlijnen voor artsen of informatie brochures voor patiënten of verzorgers. Door gestandaardiseerde follow-up, en nauwe samenwerking tussen artsen en onderzoekers optimaliseren we de zorg en het onderzoek binnen ENCORE. Op die manier kunnen we uiteindelijk betere behandelingen ontwikkelen voor zeldzame aandoeningen. U kunt daarom gevraagd worden om deel te nemen aan onderzoek. Deelname aan onderzoek is altijd op vrijwillige basis. De verkregen data wordt in anonieme vorm opgeslagen en geanalyseerd. Al het onderzoek is vooraf goedgekeurd door een ethische toetsingscommissie.
Bij alle patiënten die in ons expertisecentrum gezien worden zal genetisch onderzoek verricht worden om de genetische oorzaak vast te stellen en de ouders te kunnen ondersteunen en adviseren. Indien dit genetisch onderzoek elders al gebeurd is, zal dit niet opnieuw gedaan worden. Deze genetische kennis helpt ons ook om het effect van de genetische verandering (‘mutatie’) op de ernst van de symptomen beter te begrijpen. Tevens kunnen we dan onderzoeken welke behandeling het beste werkt voor een bepaalde genetische verandering. In sommige gevallen is de genetische verandering niet eenduidig. In die gevallen zal de genetische verandering verder onderzocht worden op het laboratorium (zie pre-klinisch onderzoek). ENCORE heeft bijgedragen aan het verder verbeteren van NF1 diagnostiek (van Minkelen, Clinical Genetics, 2013).
Binnen ENCORE hebben we ook gekeken naar het effect van het type NF1 mutatie op cognitieve functies (IQ). Hieruit kwam dat alle verschillende NF1 mutaties vergelijkbare effecten geven, met de uitzondering van de zogenaamde chromosomale micro-deletie. NF1 patiënten met deze mutatie zijn meer aangedaan (Ottenhoff, Genetics in Medicine, 2020).
Gedetailleerde kennis over het beloop van Neurofibromatose type 1 (welke symptomen en klachten zijn er, en wanneer ontstaan die precies) is van groot belang om in de toekomst klachten voortijdig te kunnen herkennen en optimaal te behandelen. Daarnaast is dit van groot belang voor geneesmiddelen onderzoek (trials). Immers, alleen als we kunnen aantonen dat een nieuw medicijn de kwaliteit van leven verbetert ten opzichte van een onbehandelde patiënt, zal het medicijn daadwerkelijk goedgekeurd en vergoed worden. ENCORE heeft zeer veel onderzoek verricht op dit gebied, met name wat betreft de cognitieve functies, en de impact die dat heeft op het dagelijks functioneren. Ook heeft ENCORE veel onderzoek gedaan naar de oorzaken van de cognitieve problemen bij zowel patiënten als muismodellen van NF1 (zie ‘Onze publicaties’ en de preklinische onderzoek pagina’s op deze site).
Klinische trials
ENCORE heeft een aantal klinische trials verricht om te kijken of de cognitieve problemen bij NF1 verminderd kunnen worden. We vonden geen aanwijzing dat Statines verbetering gaven. Momenteel wordt onderzocht of Lamotrigine een verbetering kan geven.
De TRAIN studie
Naast deze cognitieve trials worden er momenteel klinische trials verricht met een ‘MEK inhibitor’ die zich richten op de behandeling van de plexiforme neurofibromen die bij ongeveer de helft van de NF1-patiënten voorkomen. Plexiforme neurofibromen kunnen cosmetisch zeer belastend zijn, maar ook leiden tot neurologische uitval, botvergroeiingen, blindheid en agressieve kanker. Ze zijn slecht operabel omdat ze te goed doorbloed zijn. Er is tot nu toe nog geen behandeling voor deze plexiforme neurofibromen. Daarom zijn medicijnen hard nodig. Recent onderzoek laat zien dat kinderen met NF1 en een niet-te-opereren plexiform neurofibroom baat hadden bij een medicinale behandeling. Naar aanleiding van deze studie gaat het Erasmus MC een onderzoek uit voeren met trametinib bij volwassen NF1-patiënten met plexiforme neurofibromen die klachten geven. Klik hier voor Engelstalige informatie op trialregister.nl over deze studie (inclusief in- en exclusiecriteria).
Uitkomstmaten
Voor het verrichten van cognitieve trials is het erg belangrijk om snel en objectief vast te kunnen stellen in een klein groepje patiënten of het medicijn mogelijk werkt of niet. Daarom richten we ons nu op het ontwikkelen van technieken om deze ‘uitkomstmaten’ te bepalen. We doen dat onder andere door gebruik te maken van transcraniale magnetische stimulatie (TMS).
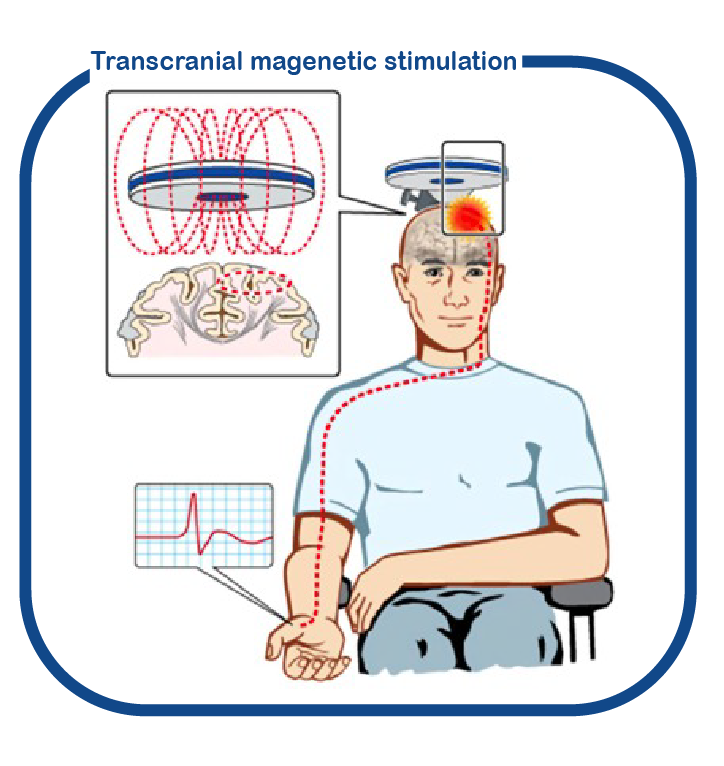
Bron: DOI: 10.3389/fneur.2018.01141
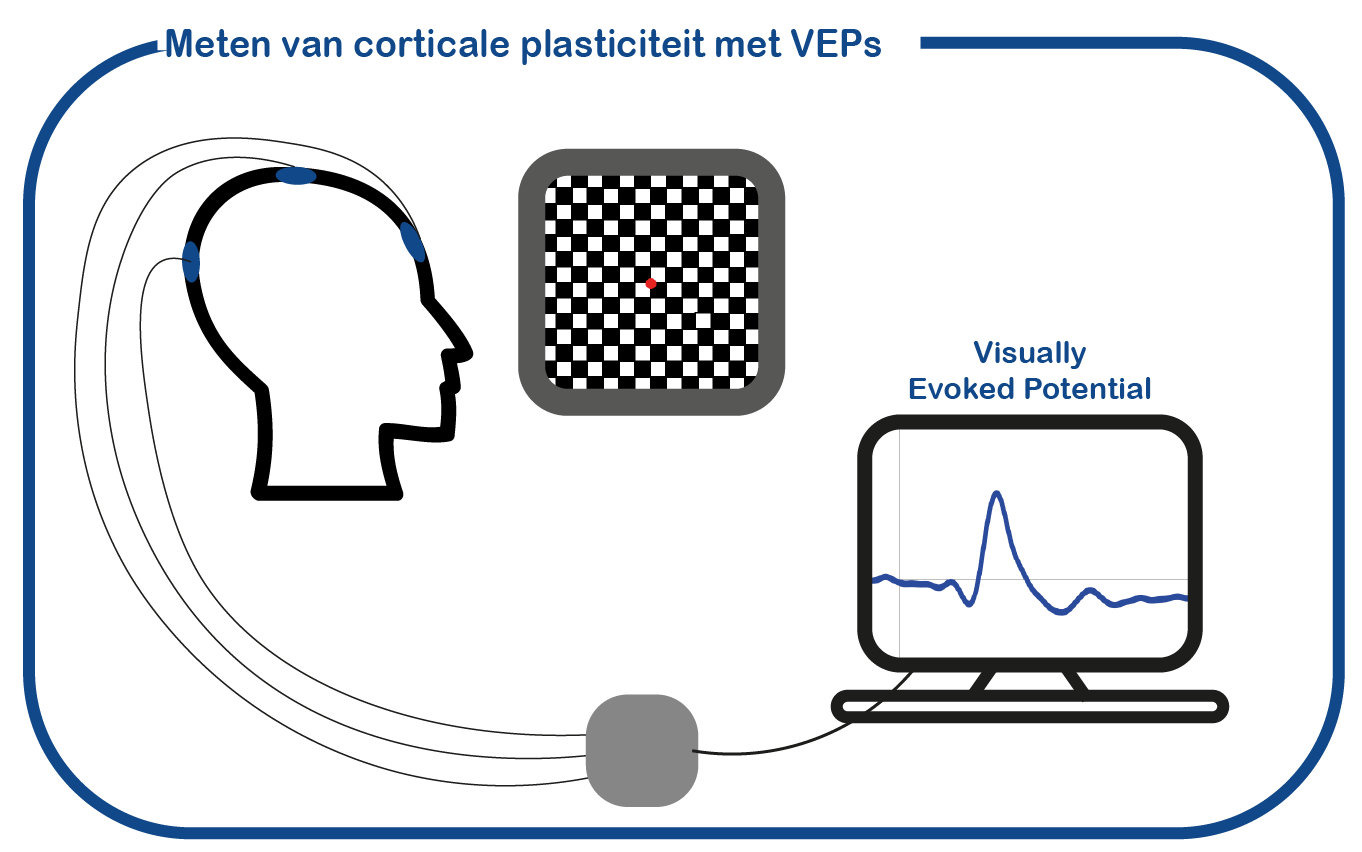
Daarnaast maken we gebruik van EEG metingen om de plasticiteit van de visuele cortex te meten door ‘visual evoked potentials’ te meten.
EU-pearl
Het ENCORE-NF1 expertisecentrum participeert in het consortium EU-pearl, een samenwerkingsverband tussen 8 ziekenhuizen, een aantal farmaceutische partners, en EFPIA, welk beoogt om een kader op te zetten voor ‘multicenter multinational platform trials’ voor een aantal ziektebeelden. ErasmusMC-NF1 is werkgroep leider voor ‘WP7 Neurofibromatosis’. De algemene doelen zijn het opzetten van een klinisch onderzoeksnetwerk voor trials in NF in Europa, het ontwikkelen van platform trials voor medicamenteuze behandeling van complicaties voor NF, en het opzetten van een langdurige studie naar de geschiedenis van manifestaties bij NF. Klik hier voor meer informatie over het EU-pearl consortium.
FACE-NF1 – ‘MultiFACEt’ aanpak om de ontwikkeling van NF1 te voorspellen
Het complexe beloop van NF1 ontrafeld vanuit verschillend perspectief. Met gebruik van klinische gegevens, erfelijke factoren en biomarkers ontwikkelen we een persoonlijk risico profiel voor mensen met NF1 gerelateerde plexiforme neurofibromen voor een behandeladvies op maat.
Dit onderzoek wil, door een combinatie van klinische, genetische en biologische informatie, voorspellen hoe goedaardige en kwaadaardige tumoren zich ontwikkelen bij mensen met NF1. Dit helpt om behandelingen en opvolging te verbeteren in de toekomst. De kracht van het onderzoek ligt in het opzetten van een landelijke systeem waar alle informatie over NF1 patiënten ingevoerd en bewaard gaan worden (een database), inclusief de opslag van weefselmateriaal, dat na een ingreep of operatie veiliggesteld wordt (een biobank).
Dhaenens BAE, et.al. (2024) The PlexiQoL, a patient-reported outcome measure on quality of life in neurofibromatosis type 1-associated plexiform neurofibroma: translation, cultural adaptation and validation into the Dutch language for the Netherlands. J Patient Rep Outcomes. Pubmed
Bennebroek CA, et.al. (2023) Treatment evaluation by volumetric segmentation in pediatric optic pathway glioma: evaluation of the effect of bevacizumab on intra-tumor components. J Neurooncol. Pubmed
Taal W, et.al. (2023) Symptomatische tumoren bij neurofibromatose type 1 Symptomatic tumors in neurofibromatosis type 1: a diagnostic challenge. Ned Tijdschr Geneeskd. Pubmed
Dhaenens BAE, et.al. (2023) Health-related quality of life of children with neurofibromatosis type 1: Analysis of proxy-rated PedsQL and CHQ questionnaires. Eur J Paediatr Neurol. Pubmed
Carton C, et.al. (2023) ERN GENTURIS NF1 Tumour Management Guideline Group. ERN GENTURIS tumour surveillance guidelines for individuals with neurofibromatosis type 1. Pubmed
Castricum J, et.al. (2023) Visual-spatial and visuomotor functioning in adults with neurofibromatosis type 1. J Intellect Disabil Res. Pubmed
Ottenhoff MJ, et.al. (2022) Cerebellum-dependent associative learning is not impaired in a mouse model of neurofibromatosis type 1. Sci Rep. Nov 9;12(1):19041. Pubmed
Douben HCW, et.al. (2022) High-yield identification of pathogenic NF1 variants in skin fibroblast transcriptome screening after apparently normal diagnostic DNA testing. Hum Mutat. Pubmed
Castricum J, et.al. (2022) Plasticity of visual evoked potentials in patients with neurofibromatosis type 1. Clin Neurophysiol. Pubmed
Lubbers K, et.al. (2022) Autism Symptoms in Children and Young Adults With Fragile X Syndrome, Angelman Syndrome, Tuberous Sclerosis Complex, and Neurofibromatosis Type 1: A Cross-Syndrome Comparison. Front Psychiatry. Pubmed
Dhaenens BAE, et.al. (2021) Lessons learned from drug trials in neurofibromatosis: A systematic review. Eur J Med Genet. 2021 Jul 5:104281. Pubmed
Castricum J, Tulen JHM, Taal W, Rietman AB, Elgersma Y (2021). Attention and Motor Learning in Adult Patients with Neurofibromatosis Type 1. J Atten Disord. Pubmed
Dhaenens BAE, et.al. (2021). Identifying challenges in neurofibromatosis: a modified Delphi procedure. Eur J Hum Genet. 26:1–9 Pubmed
Fangusaro J, et.al. (2020) Response assessment in paediatric low-grade glioma: recommendations from the Response Assessment in Pediatric Neuro-Oncology (RAPNO) working group. Lancet Oncol. 21(6); e305-16. Pubmed
Amirnasr A, et.al. (2020) Deregulated microRNAs in neurofibromatosis type 1 derived malignant peripheral nerve sheet tumors. Sci. Rep. 10:2927. Pubmed
Castricum J, et.al. (2020) Motor cortical excitability and plasticity in patients with neurofibromatosis type 1. Clin Neurophysiol. 131(11); 2673-81. Pubmed
Ottenhoff MJ, et al.(2020) Examination of the genetic factors underlying the cognitive variability associated with neurofibromatosis type 1. Genet Med.1-9. Pubmed
Frebourg T, et.al. (2020) Guidelines for the Li-Fraumeni and heritable TP53 related cancer syndromes. Eur J Hum Genet. 28(10); 1379-86. Pubmed
Siebelt M, et al. (2019) Congenital Forearm Pseudarthrosis, a Systematic Review for a Treatment Algorithm on a Rare Condition. J Pediatr Orthop. 40; e367-74. Pubmed
Vos JR, et.al. (2019) Boosting care and knowledge about hereditary cancer: European Reference Network on Genetic Tumour Risk Syndromes. Fam Cancer. 18(2); 281-4. Pubmed
Koczkowska M, et.al. (2019) Expanding the clinical phenotype of individuals with a 3-bp in-frame deletion of the NF1 gene (c.2970_2972del): an update of genotype-phenotype correlation. Genet. Med. 21(4); 867-76. Pubmed
Rietman AB, et al. (2018) Emotional and behavioral problems in children and adolescents with neurofibromatosis type 1. Am J Med Genet B Neuropsychiatr Genet. 177; 319–28. Pubmed
Rietman AB, et al. (2018) Worries and needs of adults and parents of adults with neurofibromatosis type 1. Am J Med Genet A. 176; 1150–60. Pubmed
Eijk S, et al. (2018) Autism Spectrum Disorder in an Unselected Cohort of Children with Neurofibromatosis Type 1 (NF1). J Autism Dev Disord. 48; 2278–85. Pubmed
Amirnasr A, et.al. (2017) Expression and inhibition of BRD4, EZH2 and TOP2A in neurofibromas and malignant peripheral nerve sheath tumors. PLoS One. 12(8); e0183155. Pubmed
Rietman AB, et al. (2017) Development of emotional and behavioral problems in neurofibromatosis type 1 during young childhood. Am J Med Genet A. 173; 2373–80. Pubmed
Rietman AB, et al. (2017) Motor problems in children with neurofibromatosis type 1. J Neurodev Disord. Pubmed
van der Vaart T, et al. (2016) Behavioral and cognitive outcomes for clinical trials in children with neurofibromatosis type 1. Neurology 86;154–60. Pubmed
Omrani A, et al. (2015) HCN channels are a novel therapeutic target for cognitive dysfunction in Neurofibromatosis type 1. Mol Psychiatry 20; 1311–21. Pubmed
Omrani A, et.al. (2015) Neurofibromin regulates HCN activity in Parvalbumin-positive interneurons. Mol Psychiatry. 20; 1263. Pubmed
Van Der Vaart, T. et al. (2013) Simvastatin for cognitive deficits and behavioural problems in patients with neurofibromatosis type 1 (NF1-SIMCODA): a randomised, placebo-controlled trial. Lancet Neurol 12, 1076–1083. Pubmed
van Minkelen, R. et al. (2013) A clinical and genetic overview of 18 years neurofibromatosis type 1 molecular diagnostics in the Netherlands. Clin Genet. Pubmed
Acosta, M.T. et al. (2012) The Learning Disabilities Network (LeaDNet): using neurofibromatosis type 1 (NF1) as a paradigm for translational research. Am J Med Genet A 158, 2225–2232. Pubmed
van der Vaart, T. et al. (2011) Motor deficits in neurofibromatosis type 1 mice: the role of the cerebellum. Genes Brain Behav 10, 404–409. Pubmed
Krab, L.C. et al. (2011) Motor learning in children with neurofibromatosis type I. Cerebellum 10, 14–21. Pubmed
Krab, L.C. et al. (2009) Health-related quality of life in children with neurofibromatosis type 1: contribution of demographic factors, disease-related factors, and behavior. J Pediatr 154, 420–5, 425.e1. Pubmed
Denayer, E. et al. (2008) Spred1 is required for synaptic plasticity and hippocampus-dependent learning. J Neurosci 28, 14443–14449. Pubmed
Cui, Y. et al. (2008) Neurofibromin regulation of ERK signaling modulates GABA release and learning. Cell 135, 549–560. Pubmed
Krab, L.C. et al. (2008) Impact of neurofibromatosis type 1 on school performance. J Child Neurol 23, 1002–1010. Pubmed
Krab, L.C. et al. (2008) Effect of simvastatin on cognitive functioning in children with neurofibromatosis type 1: a randomized controlled trial. JAMA 300, 287–294. Pubmed
Balgobind, B.V. et al. (2008) Leukemia-associated NF1 inactivation in patients with pediatric T-ALL and AML lacking evidence for neurofibromatosis. Blood 111, 4322–4328. Pubmed
van Engelen, S.J.P.M. et al. (2008) Quantitative differentiation between healthy and disordered brain matter in patients with neurofibromatosis type I using diffusion tensor imaging. AJNR Am J Neuroradiol 29, 816–822. Pubmed
Oostenbrink, R. et al. (2007) Parental reports of health-related quality of life in young children with neurofibromatosis type 1: influence of condition specific determinants. J Pediatr 151, 182–6– 186.e1–2. Pubmed
Cnossen, M.H. et al. (1998) Minor disease features in neurofibromatosis type 1 (NF1) and their possible value in diagnosis of NF1 in children. J Med Genet 35, 624–627. Pubmed
Cnossen, M.H. et al. (1998) A prospective 10 year follow up study of patients with neurofibromatosis type 1. Arch. Dis. Child. 78, 408–412. Pubmed
Cnossen, M.H. et al. (1997) Endocrinologic disorders and optic pathway gliomas in children with neurofibromatosis type 1. Pediatrics 100, 667–670. Pubmed
Cnossen, M.H. et al. (1997) Diagnostic delay in neurofibromatosis type 1. Eur J Pediatr 156, 482–487. Pubmed
Cnossen, M.H. et al. (1997) Deletions spanning the neurofibromatosis type 1 gene: implications for genotype-phenotype correlations in neurofibromatosis type 1? Hum Mutat 9, 458–464. Pubmed
Heeft u vragen over onderzoek bij ENCORE? Of wilt u deelnemen? Neem dan contact met ons op via encore@erasmusmc.nl of nf1centrum@erasmusmc.nl
