Costello en CFC zijn autosomaal dominante genetische aandoeningen. Deze aandoeningen behoren tot een grote groep aandoeningen die RASopathieën worden genoemd, waarbij de genproducten (eiwitten) verwante functies hebben. Deze eiwitten vormen een signaalcascade in de cel. De centrale knooppunten van deze signaalroute worden gevormd door de RAS-eiwitten. De meest voorkomende mutatie die deze route beïnvloedt, is de NF1-mutatie. De RAS-route (weergegeven in rood in de figuur) is nauw verbonden met de mTOR-route en samen regelen ze de eiwitsynthese in de cel. Bij delende cellen is RAS-signalering nodig voor het maken van nieuwe eiwitten om de groei te bevorderen, en verhoogde RAS-signalering in deze cellen kan tot kanker leiden. In de hersenen is RAS-signalering nodig om eiwitten te synthetiseren om nieuwe synaptische verbindingen tussen neuronen te vormen. Verbeterde RAS-signalering in de hersenen leidt tot cognitieve stoornissen.
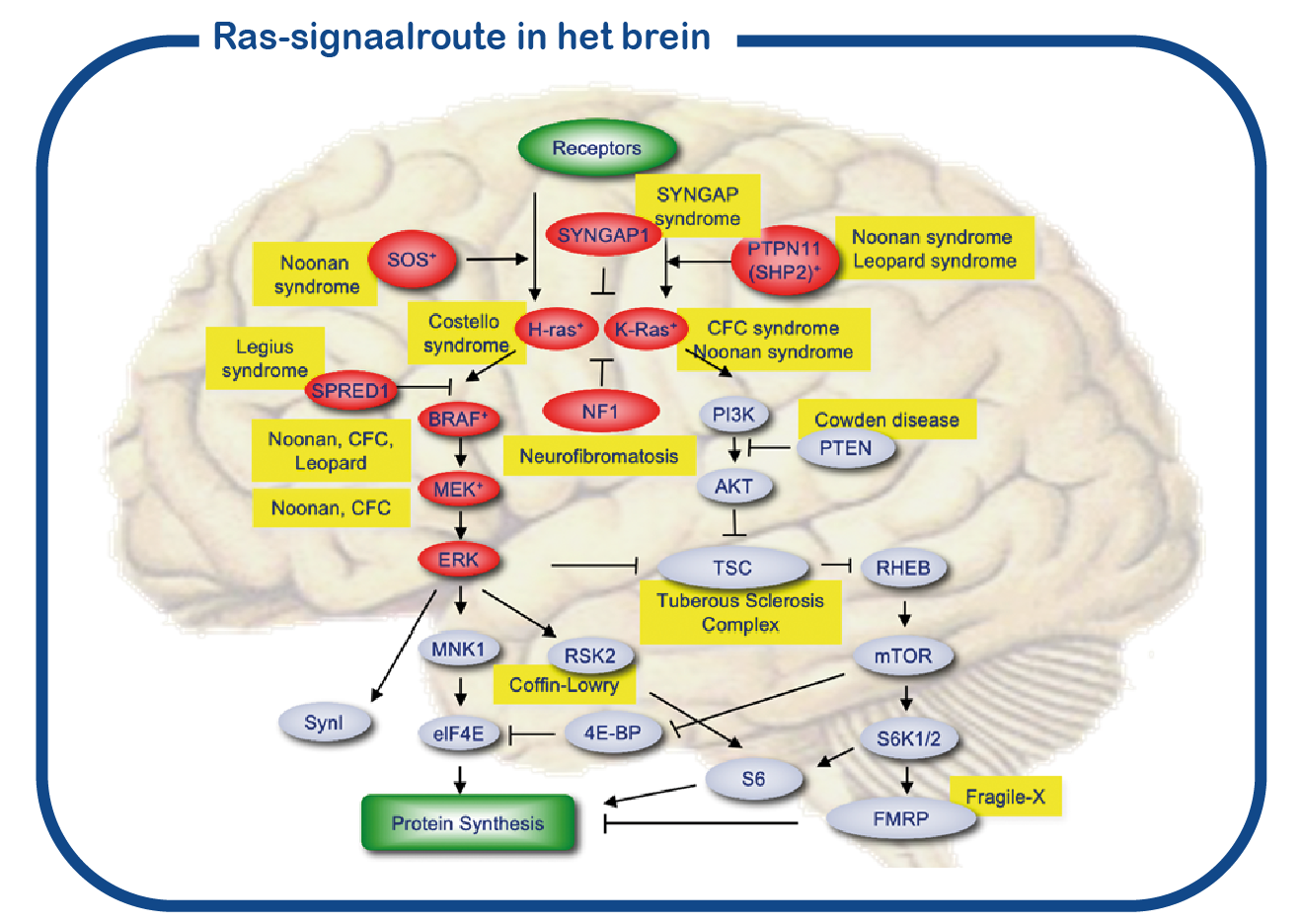
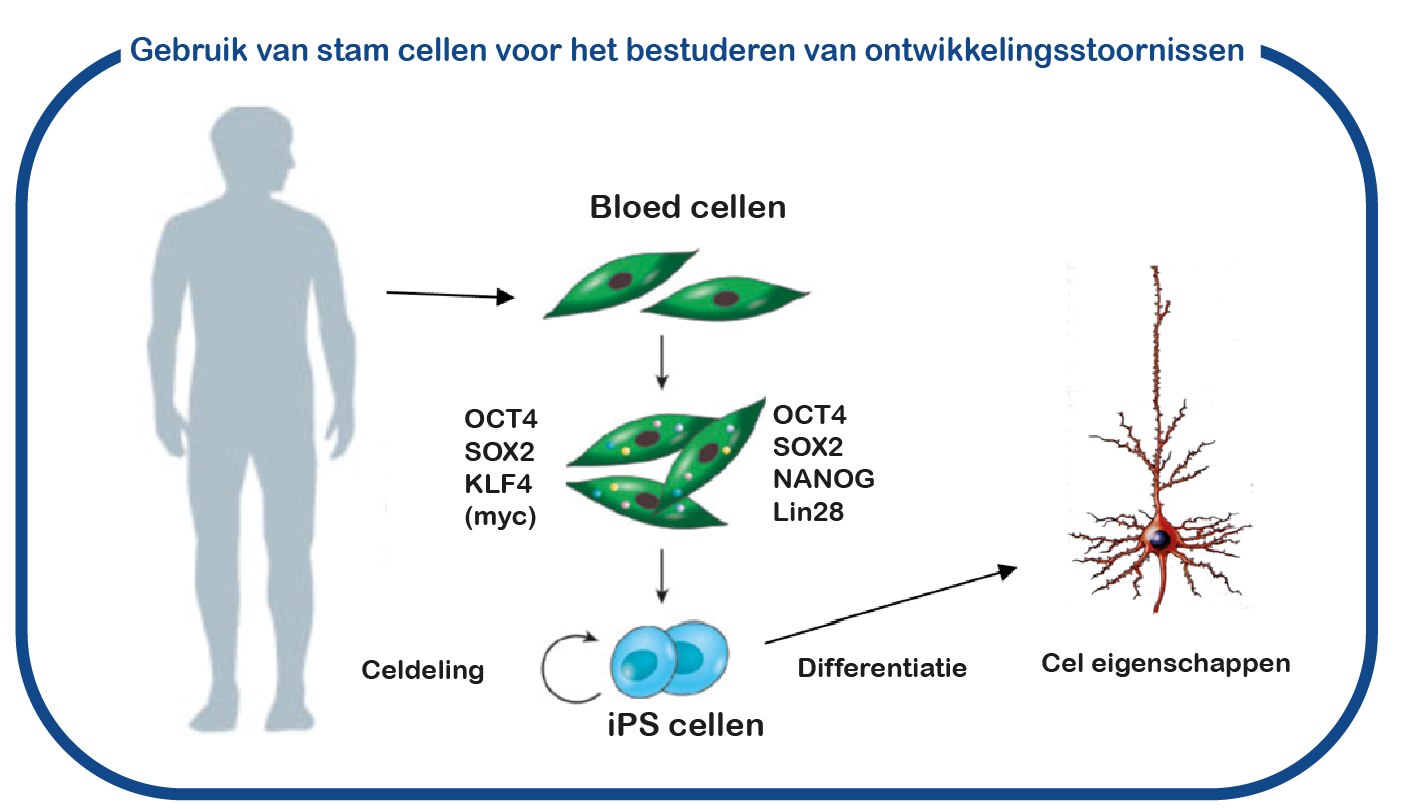
Bij ENCORE bestuderen we de RASopathieën voornamelijk door NF1 en Costello syndroom te bestuderen. We richten ons voornamelijk op de cognitieve gebreken die geassocieerd zijn met verhoogde activiteit van de RAS-signaalroute bij RASopathieën. Daarvoor maken we gebruik van het Nf1 en Costello muismodel (Omrani, Molecular Psychiatry, 2015; Schreiber, Scientific reports, 2017). We gebruiken cognitieve testen om de leerachterstanden te beoordelen en om te proberen deze tekorten te verbeteren met geneesmiddelen die op het RAS- signaalroute zijn gericht. Naast het gebruik van muismodellen gebruiken we ook geïnduceerde pluripotente stamcellen (iPS). Deze stamcellen worden gegenereerd uit bloedcellen die zijn gedoneerd door patiënten en niet-aangedane familieleden. Het grote voordeel van dergelijke iPS-cellen is dat we deze cellen kunnen differentiëren tot menselijke neuronen, waardoor we menselijke (patiënt) neuronen in een kweekschaal kunnen bestuderen. Met deze benadering hopen we te ontcijferen hoe verhoogde RAS activiteit de hersenen ontregelt en om nieuwe geneesmiddelen te identificeren die de hersencel functie herstelt.
Gripp KW, et al. (2019) Costello Syndrome: Clinical phenotype, genotype, and management guidelines. Am J Med Gent A. 179 (9); 1725-1744. Pubmed
Schreiber J, et al. (2017) Mechanisms underlying cognitive deficits in a mouse model for Costello Syndrome are distinct from other RASopathy mouse models. Sci Rep. Pubmed
Wang T, et.al. (2015) In vivo synaptic transmission and morphology in mouse models of tuberous sclerosis, Fragile X syndrome, Neurofibromatosis type 1, and Costello syndrome. Front Cell Neurosci. Pubmed
Omrani A, et al. (2015) HCN channels are a novel therapeutic target for cognitive dysfunction in Neurofibromatosis type 1. Mol Psychiatry 20; 1311–21. Pubmed
Beukers, W. et al. (2013) HRAS mutations in bladder cancer at an early age and the possible association with the Costello Syndrome. Eur J Hum Genet DOI: 10.1038/ejhg.2013.251. Pubmed
Krab, L.C. et al. (2008) Oncogenes on my mind: ERK and MTOR signaling in cognitive diseases. Trends Genet 24, 498–510. Pubmed
Kushner, S.A. et al. (2005) Modulation of presynaptic plasticity and learning by the H-ras/extracellular signal-regulated kinase/synapsin I signaling pathway. J Neurosci 25, 9721–9734. Pubmed
